搜索


上海交大张大兵教授研究团队经过5年的研究,克隆并鉴定了一个参与调控单子叶植物水稻花药发育的碱性螺旋-环-螺旋转录因子(basic Helix-Loop-Helix transcription factore),EAT1(Eternal Tapetum 1),并提出植物发育性的程序性细胞死亡新机制(如下图所示)。该研究成果已经被《自然通讯》(Nature Communications)2013年2月5日发表。
程序性细胞死亡(Programmed Cell Death, PCD)是广泛存在的一种死亡方式,在细胞分化和个体发育中起到至关重要的作用。植物基因组中缺乏动物PCD过程的效应蛋白——胱冬酶(Caspase),但许多植物细胞死亡过程表现为类似于动物PCD的行为,例如染色质片断化、线粒体异常、细胞色素c(Cyt c)的释放、caspase特异性底物活性反应等。但是植物中程序性细胞死亡控制机理? 什么类型蛋白可以发挥类似胱冬酶在PCD中的功能?
绒毡层是植物花药最内层壁,在小孢子发育过程中,逐渐死亡,为小孢子发育提供营养和能量。绒毡层是植物发育性细胞死亡的理想的模式组织。通过遗传学张大兵教授团队研究发现了一个在绒毡层中特异性表达的bHLH转录因子,EAT1,可以在转录水平上直接调节两个天冬氨酸蛋白酶(Aspartic Preotease,ASP)的表达。ASPs在酵母、拟南芥和烟草体内过表达,会造成细胞和组织的死亡,说明ASPs具有广谱的死亡促进者作用,而EAT1则是通过控制ASP表达执行死亡起始的作用。体内和体外实验证明EAT1蛋白能够与调控绒毡层细胞死亡的另一个bHLH转录因子,TDR(TAPETUM DEGENERATION RETARDATION,Plant Cell,全文下载:http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1693939/)直接作用。张大兵教授团队2006年的结果证明,TDR通过直接调节一个半胱氨酸蛋白酶OsCP1(Cysteine Protease 1)的表达控制绒毡层细胞死亡。 基因表达分析结果表明TDR对绒毡层的发育调控可能部分通过EAT1实现; 有趣的是, EAT1不能直接调节OsCP1的表达,TDR也不能直接调节ASPs的表达。说明在绒毡层细胞死亡调控过程中,EAT1和TDR可能存在着不同的分工。这项研究为全面认识花粉发育以及细胞程序性死亡等生物学过程提供了新的认识(http://www.nature.com/ncomms/journal/v4/n2/abs/ncomms2396.html?WT.ec_id=NCOMMS-20130205) 。
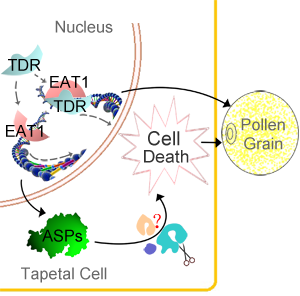
EAT1花药绒粘层细胞程序性死亡作用机制的示意图


 英国上市公司官网365
英国上市公司官网365

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: