搜索
关闭 X


赵一雷团队在硫酯酶催化聚酮环化反应机制解析中取得突破
发布时间 :2016-07-05
阅读次数 :3452
近日,美国化学会刊物ACS Catalysis在线发表了英国上市公司官网365赵一雷教授研究团队的文章 “Theoretical Studies on the Mechanism of Thioesterase-Catalyzed Macrocyclization in Erythromycin Biosynthesis”(DOI: 10.1021/acscatal.6b01154),博士研究生陈雄平和石婷副研究员为并列第一作者。通过与邓子新研究团队的白林泉教授合作,该研究借助计算模拟方法深入解析了红霉素DEBS硫酯酶催化聚酮链环化反应的机制。
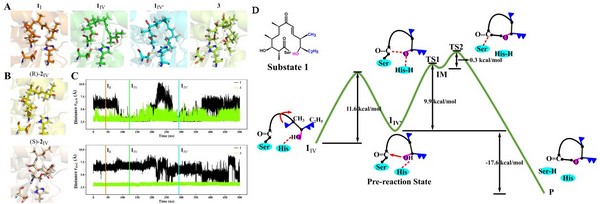
该研究从结构高度相似的两个小分子探针底物入手,运用分子动力学模拟技术,分析了在酶中环化和水解两条反应途径中底物-酶共价复合物的动态结构差异,发现在底物与酶的分子识别过程中,C7位为羰基的底物分子通过诱导契合互作更容易形成一个特异性的环化预反应态(prereaction state),从而促成了环化产物的生成;而C7位为羟基的底物缺乏这种分子识别机制,导致了水解副反应的发生。运用QM与QM/MM方法,研究团队捕捉到了反应中间体及过渡态,通过计算出环化反应的能垒预测了在反应过程中可能起到决定作用的一系列氨基酸残基(例如Leu183、Ala143、Phe260等等)。对该酶天然底物红霉素前体的计算验证了预反应态的形成决定了酶催化环化反应趋势。
该论文研究结果表明,预反应态理论可能在生物合成酶系中广泛存在,是目标反应能否发生的一个关键条件,从而可能成为生物合成元件间适配性评估与改造的一种新策略。


 英国上市公司官网365
英国上市公司官网365

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: