搜索


近期,国际合成生物学领域知名期刊——美国化学联合会合成生物学(ACS synthetic biology)在线发表了微生物代谢国家重点实验室、我院冯雁教授973团队的研究成果De NovoBiosynthesis of β‑Valienamine in EngineeredStreptomyces hygroscopicus5008,该研究通过对微生物代谢途径的重新编程,建立了“非天然产物”药物的生物合成途径,是药物合成生物学研究的新进展。
药物合成生物学是通过工程化的系统设计,用标准化和模块化的元素在生物系统中重构所需的人工合成体系,从而完善药物创新和优产的新模式。β-井冈霉烯胺属于C7N氨基环醇类,其衍生物作为β-糖苷酶抑制剂类药物的先导化合物,可用于治疗溶酶体贮积症等遗传代谢性疾病。由于C7N氨基环醇类分子结构中存在多个手性中心,化学合成难度很大,极大地限制了药物创新和应用,因此从上世纪八十年代至今,国际上对其高效合成途径在不断探索中。
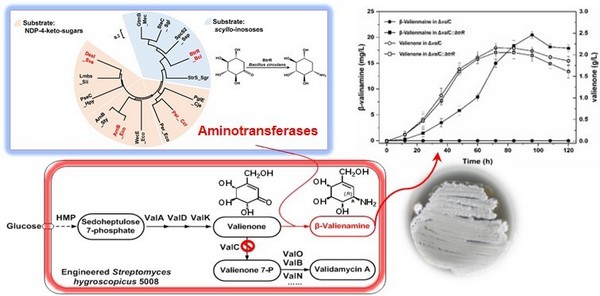
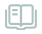
冯雁教授研究团队应用合成生物学理念,系统地分析了目标产物与微生物次级代谢产物结构的相似性、异源微生物酶催化反应的立体选择性及催化效率、微生物天然产物合成途径的模块性,以及合成代谢多途径的竞争性等特点。他们以吸水链霉菌井冈霉素生物合成途径为主,引入高度立体选择性的芽孢杆菌氨基转移酶(产物光学纯度 > 99.9 %)基因,并敲除相关酶基因以阻断竞争途径,获得了发酵培养96小时可产生20 mg/L β-井冈霉烯胺的突变菌株。本研究中构建的新的生物合成途径不仅解决了原有化学合成方法步骤多、安全性低等问题,更重要的是对“非天然产物”药物在微生物中生物合成进行了有益尝试。本研究还助于阐明生物体中复杂酶及代谢途径等模块组装合理性、有效性等合成生物学基础理论问题。
相关研究得到科技部973项目、国家自然科学基金青年基金和教育部博士点基金资助。


 英国上市公司官网365
英国上市公司官网365

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: